Tujuan : mengamati kadar vitamin C dalam minuman.
Teori dasar : pengamat dapat mengetahui kandungan vitamin C yang terkandung salam minuman vitamin C dari berbagai sampel.
Alat dan Bahan
Alat :
-Spatula Porseline
-Gelas Kimia 100 ml 3 buah
-Spiritus
-Serbet
-Pipet
Bahan :
-Maizena
-Iodine
-Minute Maid Pulpy Orange
-Vitamin water
-Ale-ale strawberry (yang sudah dicampur dengan air)
-U C 1000 Lemon
-ABC sari kacang hijau
-Okky jelly drink orange
-Buavita lechy
-Nutrisari orange
-Jungle Juice Guava
Cara Kerja :
Pertama, buat kanji dari Maizena. campurkan tepung maizena dengan 1/4 gelas airdan aduk dengan cepat sampai semua tepung larut.
Kedua, siapkan sampel minuman yang telah disiapkan tadi didalam gelas kimia 100ml.
Ketiga, masukan 1sdm tepung maizena ke dalam gelas kimia yang telah disiapkan di No.2
Keempat, teteskan 2 tetes Iodine ke dalam sampel minuman vitamin C. teteskan terus sampai larutan
berwarna biru kehitaman. Hentikan tetesan jika larutan sudah berwarna biru kehitaman.
Terakhir, catat berapa tetes yang dibutuhkan untuk membuat larutan menjadi berwarna biru kehitaman tadi.
Data hasil pengamatan
okky Jelly Drink (Orange) :
3 tetes
Ale-Ale (Strawberry) : 3 tetes
Vitamin Water (Strawberry) : 3 tetes
Jungle Juice (Guava) : 9 tetes
Segar Sari (Orange) :
22 tetes
Buavita (Lechy) : 49 tetes
Pulpy (Orange) :
191 tetes
Nutrisari (Orange) :
244 tetes
U C 1000 (Lemon) :
lebih dari 1500 tetes
KESIMPULAN
Semakin banyak tetesan yang diperlukan untuk menghitamkan larutan, berarti semakin banyak pula kandungan vitamin C yang terkandung dalam minuman tersebut.
Senin, 16 Desember 2013
Minggu, 15 Desember 2013
PRAKTIKUM KIMIA "PENURUNAN TITIK BEKU"
Tujuan Praktikum : Mengamati adanya penurunan titik beku karena adanya zat pelarut
Teori Dasar : Penurunan titik beku karena adanya zat
terlarut
Alat dan Bahan :
Alat :
- Gelas Kimia
- Tabung Reaksi
- Pengaduk
- Termometer
Bahan :
- Es Batu
- garam kasar
- Aquades
- Urea 1M dan 2M
- NaCl 1M dan 2M
Pertama, isi gelas kimia dengan garam kasar dan es batu.
Kedua, isi masing-masing tabung reaksi dengan Aquades, Urea 1M dan 2M, dan NaCl 1M dan 2M.
Ketiga, masukan tabung reaksi yang berisi Aquades, Urea 1M dan 2M, dan NaCl 1M dan 2M ke dalam gelas kimia yang telah di isi dengan es batu dan garam kasar.
Terakhir, catat suhu tiap 30 detik sampai suhu tiap-tiap tabung reaksi yang isi larutannya membeku (suhu tetap).
Data hasil percobaan :
1. Larutan aquades tidak berkonsentrasi Tf nya O derajat celcius.
2. Larutan Urea konsentrasi 1M Tfnya -9 derajat celcius.
3. Larutan Urea konsentrasi 2M Tfnya -10 derajat celcius.
4. Larutan NaCl konsentrasi 1M Tfnya -8 derajat celcius.
5. Larutan NaCl konsentrasi 2M Tfnya -8 derajat celcius.
Analisis Data :
1. Hitung Kf percobaan !
2. Hitung Kf rata-rata percobaan !
3. % kesalahan mutlak !
1. Aquades : TF = m . Kf
0 = 0 . Kf
KF = 0
Urea 1m : -9 = 1 . KF
KF = -9
Urea 2m : -10 = 2 . KF
KF = -5
NaCl 1m : -8 = 1 . KF
KF = -8
NaCl 2m : -8 = 2 . KF
KF = -4
3. % kesalahan mutlak
= 3,795 x 100% = 379,5 %
KESIMPULAN
Faktor yang mempengaruhi penurunan titik beku antara lain adalah konsentrasi larutan dan sifat larutannya. yaitu elektrolit atau non elektrolit.
Jumat, 15 November 2013
Kamis, 18 Juli 2013
Konsentrasi Larutan
asi Larutan Konsetrasi larutan merupakan cara untuk menyatakan hubungan kuantitatif antara zat terlarut dan pelarut.

Contoh :
Berapakah molaritas 0.4 gram NaOH (Mr = 40) dalam 250 mL larutan ?
Jawab :


Mol-ekivalen :
Rumus Molalitas adalah :

Contoh :
Berapa molalitas 4 gram NaOH (Mr=40) dalam 500 gram air?
Jawab :
molalitas NaOH
= (4/40)/500 g air
= (0.1 x 2 mol)/1000 g air
= 0,2 m
Contoh :
Suatu larutan terdiri dari 2 mol zat A, 3 mol zat B, dan 5 mol zat C. Hitung fraksi mol masing-masing zat !
Jawab :
XA = 2 / (2+3+5) = 0.2
XB = 3 / (2+3+5) = 0.3
XC = 5 / (2+3+5) = 0.5
XA + XB + XC = 1
- Konsentrasi : jumlah zat tiap satuan volum (besaran intensif)
- Larutan encer : jumlah zat terlarut sangat sedikit
- Larutan pekat : jumlah zat terlarut sangat banyak
- Cara menyatakan konsentrasi: molar, molal, persen, fraksi mol, bagian per sejuta (ppm), dll
Molaritas (M)
Molaritas adalah jumlah mol zat terlarut dalam satu liter larutan. Rumus Molaritas adalah :
Contoh :
Berapakah molaritas 0.4 gram NaOH (Mr = 40) dalam 250 mL larutan ?
Jawab :

Normalitas (N)
Normalitas merupakan jumlah mol-ekivalen zat terlarut per liter larutan. Terdapat hubungan antara Normalitas dengan Molaritas, yaitu :Mol-ekivalen :
- Asam/basa: jumlah mol proton/OH- yang diperlukan untuk menetralisir suatu asam / basa.
Contoh :
1 mol Ca(OH)2 akan dinetralisir oleh 2 mol proton;
1 mol Ca(OH)2 setara dengan 1 mol-ekivalen; Ca(OH)2 1M = Ca(OH)2 2N
- Redoks : jumlah mol elektron yang dibutuhkan untuk mengoksidasi atau mereduksi suatu unsur
Contoh :
1 mol Fe+3 membutuhkan 3 mol elektron untuk menjadi Fe;
1 mol Fe+3 setara dengan 3 mol-ekivalen;
Fe+3 1 M = Fe+3 3 N atau Fe2O3 6 N
Molalitas (m)
Molalitas adalah jumlah mol zat terlarut dalam 1000 gram pelarut.Rumus Molalitas adalah :

Contoh :
Berapa molalitas 4 gram NaOH (Mr=40) dalam 500 gram air?
Jawab :
molalitas NaOH
= (4/40)/500 g air
= (0.1 x 2 mol)/1000 g air
= 0,2 m
Fraksi Mol (X)
Fraksi mol adalah perbandingan antara jumlah mol suatu komponen dengan jumlah total seluruh komponen dalam satu larutan. Fraksi mol total selalu satu. Konsentrasi dalam bentuk ini tidak mempunyai satuan karena merupakan perbandingan.Contoh :
Suatu larutan terdiri dari 2 mol zat A, 3 mol zat B, dan 5 mol zat C. Hitung fraksi mol masing-masing zat !
Jawab :
XA = 2 / (2+3+5) = 0.2
XB = 3 / (2+3+5) = 0.3
XC = 5 / (2+3+5) = 0.5
XA + XB + XC = 1
Persen
Berat (% w/w)
Persen berat menyatakan jumlah gram berat zat
terlarut dalam 100 gram larutan.
Contoh :
Larutan gula 5%, berarti dalam 100
gram larutan gula terdapat :
- (5/100) x 100 gram gula = 5 gram gula
- (100 – 5) gram air= 95 gram air
Bagian
per juta (part per million, ppm)
ppm = massa komponen larutan (g) per
1 juta g larutan. Untuk pelarut air : 1 ppm setara dengan 1 mg/liter.
Sifat Koligatif
☺ Pengertian sifat koligatif : Sifat koligatif adalah sifat yang tergantung pada konsentrasi zat terlarut
☺Sifat-sifat koligatif terdiri atas :
1. Penurunan tekanan uap
Jika zat pelarut dimasukkan dalam tempat tertutup, maka pelarut itu akan menguap. Uap itu akan menyebar kemana-mana dan memberi tekanan ke seluruh ruangan. partikel-partikel yang menjadi uap tidak selamanya menjadi uap, tetapi sebagian akan masuk ke dalam cairan lagi. Ketika sudah mencapai ketimbangan dinamis antara zat cair dan uap nya, maka uap itu menjadi jenuh. Jika uap itu sudah jenuh, maka uap itu akan dinamakan tekanan uap jenuh pelarut murni. Jika ke dalam pelarut itu anda masukkan suatu zat pelarut yang sukar menguap hingga menjadi larutan maka maka tekanan uap jenuh yang dihasilkan larutan itu disebut tekanan uap jenuh larutan. Tekanan uap jenuh larutan yang zat terlarutnya sukar menguap menghasilkan tekanan yang lebih rendah daripada tekanan uap jenuh pelarutnya. Mengapa demikian ? Jika zat pelarut anda masukkan ke dalam pelarut, maka akan ada sebagian partikel zat pelarut yang berada di permukaan larutan. Keberadaan partikel zat-zat pelarut itu akan menghalangi partikel-partikel zat terlarut untuk melepaskan diri dari larutan atau menguap. Akibatnya, tekanan uap jenuh larutan itu akan menurun. Makin tinggi konsentrasi zat terlarut, makin tinggi penurunan tekanan uap.
2. Kenaikan titik didih dan penurunan titik beku
Jika dalam pelarut murni dimasukan zat terlarut, maka titik didih larutan itu akan naik. Hal itu disebabkan partikel-partikel yang ada di larutan lebih banyak daripada partikel-partikel yang ada di pelarut. Oleh karena itu, suhu yang di butuhkan untuk melepaskan partikel-partikel yang dari larutan lebih tinggi daripada suhu yang dibutuhkan untuk melepaskan partikel-partikel pelarut.



Keterangan :
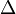 Tb = kenaikan titik didih
Tb = kenaikan titik didih
kb = tetapan kenaikan titik didih molal
m = massa zat terlarut
Mr = massa molekul relatif
Persamaannya dapat ditulis sebagai berikut :



Keterangan :
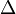 Tf = penurunan titik beku
Tf = penurunan titik beku
kf = penurunan titik beku molal
m = molal larutan
Mr = massa molekul relatif
3. Tekanan osmosis
Apabila dua larutan yang berbeda konsentrasinya dihubungkan dengan selaput semipermeabel, akan ada kecenderungan kedua larutan itu berinteraksi untuk mendaparkan konsentrasi yang sama. Selaput semipermeabel adalah selaput yang memiliki pori-pori yang dapat dilewati oleh partikel pelarut, tetapi tidak dapat dilewati oleh zat terlarut. Adanya kecenderungan kedua larutan untuk mempunyai konsentrasi yang sama, maka pelarut dari larutan yang memiliki konsentrasi lebih kecil akan mengalir ke larutan yang konsentrasinya lebih besar. Peristiwa perpindahan larutan yang memiliki konsentrasi lebih kecil (pelarut) ke larutan yang memiliki konsentrasi lebih besar (terlarut) ini dinamakan osmosis.
Perpindahan tersebut menyebabkan perbedaan ketinggian permukaan antara larutan encer dan larutan pekat. Perbedaan ketinggian ini akan mengakibatkan adanya perbedaan tekanan pada kedua larutan tersebut. Perbedaan tekanan itu disebut tekanan osmosis. Jadi dapat dikatakan bahwa tekanan osmosis adalah tekanan yang diperlukan untuk menghentikan peristiwa osmosis. Makin tinggi konsentrasi larutan maka makin tinggi pula tekanan osmosis yang diperlukan untuk menhentikan peristiwa osmosis tersebut.
Menurut Van't Hoff, tekanan osmotik larutan dirumuskan :
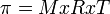
Keterangan :
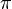 = tekanan osmotik
= tekanan osmotik
M = molaritas larutan
R = tetapan gas ( 0,082 )
T = suhu mutlak
☺Sifat-sifat koligatif terdiri atas :
1. Penurunan tekanan uap
Jika zat pelarut dimasukkan dalam tempat tertutup, maka pelarut itu akan menguap. Uap itu akan menyebar kemana-mana dan memberi tekanan ke seluruh ruangan. partikel-partikel yang menjadi uap tidak selamanya menjadi uap, tetapi sebagian akan masuk ke dalam cairan lagi. Ketika sudah mencapai ketimbangan dinamis antara zat cair dan uap nya, maka uap itu menjadi jenuh. Jika uap itu sudah jenuh, maka uap itu akan dinamakan tekanan uap jenuh pelarut murni. Jika ke dalam pelarut itu anda masukkan suatu zat pelarut yang sukar menguap hingga menjadi larutan maka maka tekanan uap jenuh yang dihasilkan larutan itu disebut tekanan uap jenuh larutan. Tekanan uap jenuh larutan yang zat terlarutnya sukar menguap menghasilkan tekanan yang lebih rendah daripada tekanan uap jenuh pelarutnya. Mengapa demikian ? Jika zat pelarut anda masukkan ke dalam pelarut, maka akan ada sebagian partikel zat pelarut yang berada di permukaan larutan. Keberadaan partikel zat-zat pelarut itu akan menghalangi partikel-partikel zat terlarut untuk melepaskan diri dari larutan atau menguap. Akibatnya, tekanan uap jenuh larutan itu akan menurun. Makin tinggi konsentrasi zat terlarut, makin tinggi penurunan tekanan uap.
2. Kenaikan titik didih dan penurunan titik beku
Jika dalam pelarut murni dimasukan zat terlarut, maka titik didih larutan itu akan naik. Hal itu disebabkan partikel-partikel yang ada di larutan lebih banyak daripada partikel-partikel yang ada di pelarut. Oleh karena itu, suhu yang di butuhkan untuk melepaskan partikel-partikel yang dari larutan lebih tinggi daripada suhu yang dibutuhkan untuk melepaskan partikel-partikel pelarut.
- Kenaikan titik didih
Titik didih zat cair adalah suhu tetap pada saat zat cair mendidih. Pada suhu ini, tekanan uap zat cair sama dengan tekanan udara di sekitarnya. Hal ini menyebabkan terjadinya penguapan di seluruh bagian zat cair. Titik didih zat cair diukur pada tekanan 1 atmosfer. Dari hasil penelitian, ternyata titik didih larutan selalu lebih tinggi dari titik didih pelarut murninya.
Hal ini disebabkan adanya partikel - partikel zat terlarut dalam suatu
larutan menghalangi peristiwa penguapan partikel - partikel pelarut. Oleh karena itu, penguapan partikel - partikel pelarut membutuhkan energi yang lebih besar
Perbedaan titik didih larutan dengan titik didih pelarut murni di sebut kenaikan titik didih yang dinyatakan dengan ( ). Persamaannya dapat ditulis :
). Persamaannya dapat ditulis :
 ). Persamaannya dapat ditulis :
). Persamaannya dapat ditulis :



Keterangan :
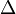 Tb = kenaikan titik didih
Tb = kenaikan titik didihkb = tetapan kenaikan titik didih molal
m = massa zat terlarut
Mr = massa molekul relatif
- Penurunan titik beku
Persamaannya dapat ditulis sebagai berikut :



Keterangan :
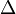 Tf = penurunan titik beku
Tf = penurunan titik bekukf = penurunan titik beku molal
m = molal larutan
Mr = massa molekul relatif
3. Tekanan osmosis
Apabila dua larutan yang berbeda konsentrasinya dihubungkan dengan selaput semipermeabel, akan ada kecenderungan kedua larutan itu berinteraksi untuk mendaparkan konsentrasi yang sama. Selaput semipermeabel adalah selaput yang memiliki pori-pori yang dapat dilewati oleh partikel pelarut, tetapi tidak dapat dilewati oleh zat terlarut. Adanya kecenderungan kedua larutan untuk mempunyai konsentrasi yang sama, maka pelarut dari larutan yang memiliki konsentrasi lebih kecil akan mengalir ke larutan yang konsentrasinya lebih besar. Peristiwa perpindahan larutan yang memiliki konsentrasi lebih kecil (pelarut) ke larutan yang memiliki konsentrasi lebih besar (terlarut) ini dinamakan osmosis.
Perpindahan tersebut menyebabkan perbedaan ketinggian permukaan antara larutan encer dan larutan pekat. Perbedaan ketinggian ini akan mengakibatkan adanya perbedaan tekanan pada kedua larutan tersebut. Perbedaan tekanan itu disebut tekanan osmosis. Jadi dapat dikatakan bahwa tekanan osmosis adalah tekanan yang diperlukan untuk menghentikan peristiwa osmosis. Makin tinggi konsentrasi larutan maka makin tinggi pula tekanan osmosis yang diperlukan untuk menhentikan peristiwa osmosis tersebut.
Menurut Van't Hoff, tekanan osmotik larutan dirumuskan :
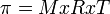
Keterangan :
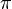 = tekanan osmotik
= tekanan osmotikM = molaritas larutan
R = tetapan gas ( 0,082 )
T = suhu mutlak
Praktikum Kimia kelas XI
☻ Tujuan Praktikum : Membuat Larutan dari zat padat NaCl 1M
☻ Alat dan bahan :
Alat : - Neraca (Timbangan)
- Spatula
- Labu Ukur
Bahan : - Air Aquades
- Larutan zat padat (Garam = NaCl)
☻ Prosedur kerja :
1. Hitunglah massa NaCl padat yang diperlukan untuk membuat larutan 100ml NaCl 1M .
2. Timbang atau ukurlah massa zat NaCl yang diperlukan untuk 100ml NaCl 1M
3. Melarutkan garam (NaCl) dengan air sebanyak 1/3 volume larutan dan diaduk menggunakan spatula.
4. Memasukan larutan nomor 3 ke dalam labu ukur dengan ukuran 100ml
5. Pembilasan larutan nomor 3 dengan air, hasil bilasan dimasukkan ke dalam labu ukur, pembilasan sebanyak minimal 3 kali sampai volume larutan segaris dengan tanda pada labu ukur. Pastikan larutan tidak melewati tanda garis sedikitpun. Agar pas garis, kita harus menghentikan penuangan sekitar 2-3 cm sebelum garis, lalu lakukan pemenuhan sampai garis dengan pipet.
☻ Alat dan bahan :
Alat : - Neraca (Timbangan)
- Spatula
- Labu Ukur
Bahan : - Air Aquades
- Larutan zat padat (Garam = NaCl)
☻ Prosedur kerja :
1. Hitunglah massa NaCl padat yang diperlukan untuk membuat larutan 100ml NaCl 1M .
2. Timbang atau ukurlah massa zat NaCl yang diperlukan untuk 100ml NaCl 1M
3. Melarutkan garam (NaCl) dengan air sebanyak 1/3 volume larutan dan diaduk menggunakan spatula.
4. Memasukan larutan nomor 3 ke dalam labu ukur dengan ukuran 100ml
5. Pembilasan larutan nomor 3 dengan air, hasil bilasan dimasukkan ke dalam labu ukur, pembilasan sebanyak minimal 3 kali sampai volume larutan segaris dengan tanda pada labu ukur. Pastikan larutan tidak melewati tanda garis sedikitpun. Agar pas garis, kita harus menghentikan penuangan sekitar 2-3 cm sebelum garis, lalu lakukan pemenuhan sampai garis dengan pipet.
Langganan:
Postingan (Atom)
















