☺Sifat-sifat koligatif terdiri atas :
1. Penurunan tekanan uap
Jika zat pelarut dimasukkan dalam tempat tertutup, maka pelarut itu akan menguap. Uap itu akan menyebar kemana-mana dan memberi tekanan ke seluruh ruangan. partikel-partikel yang menjadi uap tidak selamanya menjadi uap, tetapi sebagian akan masuk ke dalam cairan lagi. Ketika sudah mencapai ketimbangan dinamis antara zat cair dan uap nya, maka uap itu menjadi jenuh. Jika uap itu sudah jenuh, maka uap itu akan dinamakan tekanan uap jenuh pelarut murni. Jika ke dalam pelarut itu anda masukkan suatu zat pelarut yang sukar menguap hingga menjadi larutan maka maka tekanan uap jenuh yang dihasilkan larutan itu disebut tekanan uap jenuh larutan. Tekanan uap jenuh larutan yang zat terlarutnya sukar menguap menghasilkan tekanan yang lebih rendah daripada tekanan uap jenuh pelarutnya. Mengapa demikian ? Jika zat pelarut anda masukkan ke dalam pelarut, maka akan ada sebagian partikel zat pelarut yang berada di permukaan larutan. Keberadaan partikel zat-zat pelarut itu akan menghalangi partikel-partikel zat terlarut untuk melepaskan diri dari larutan atau menguap. Akibatnya, tekanan uap jenuh larutan itu akan menurun. Makin tinggi konsentrasi zat terlarut, makin tinggi penurunan tekanan uap.
2. Kenaikan titik didih dan penurunan titik beku
Jika dalam pelarut murni dimasukan zat terlarut, maka titik didih larutan itu akan naik. Hal itu disebabkan partikel-partikel yang ada di larutan lebih banyak daripada partikel-partikel yang ada di pelarut. Oleh karena itu, suhu yang di butuhkan untuk melepaskan partikel-partikel yang dari larutan lebih tinggi daripada suhu yang dibutuhkan untuk melepaskan partikel-partikel pelarut.
- Kenaikan titik didih
Titik didih zat cair adalah suhu tetap pada saat zat cair mendidih. Pada suhu ini, tekanan uap zat cair sama dengan tekanan udara di sekitarnya. Hal ini menyebabkan terjadinya penguapan di seluruh bagian zat cair. Titik didih zat cair diukur pada tekanan 1 atmosfer. Dari hasil penelitian, ternyata titik didih larutan selalu lebih tinggi dari titik didih pelarut murninya.
Hal ini disebabkan adanya partikel - partikel zat terlarut dalam suatu
larutan menghalangi peristiwa penguapan partikel - partikel pelarut. Oleh karena itu, penguapan partikel - partikel pelarut membutuhkan energi yang lebih besar
Perbedaan titik didih larutan dengan titik didih pelarut murni di sebut kenaikan titik didih yang dinyatakan dengan ( ). Persamaannya dapat ditulis :
). Persamaannya dapat ditulis :
 ). Persamaannya dapat ditulis :
). Persamaannya dapat ditulis :



Keterangan :
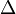 Tb = kenaikan titik didih
Tb = kenaikan titik didihkb = tetapan kenaikan titik didih molal
m = massa zat terlarut
Mr = massa molekul relatif
- Penurunan titik beku
Persamaannya dapat ditulis sebagai berikut :



Keterangan :
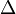 Tf = penurunan titik beku
Tf = penurunan titik bekukf = penurunan titik beku molal
m = molal larutan
Mr = massa molekul relatif
3. Tekanan osmosis
Apabila dua larutan yang berbeda konsentrasinya dihubungkan dengan selaput semipermeabel, akan ada kecenderungan kedua larutan itu berinteraksi untuk mendaparkan konsentrasi yang sama. Selaput semipermeabel adalah selaput yang memiliki pori-pori yang dapat dilewati oleh partikel pelarut, tetapi tidak dapat dilewati oleh zat terlarut. Adanya kecenderungan kedua larutan untuk mempunyai konsentrasi yang sama, maka pelarut dari larutan yang memiliki konsentrasi lebih kecil akan mengalir ke larutan yang konsentrasinya lebih besar. Peristiwa perpindahan larutan yang memiliki konsentrasi lebih kecil (pelarut) ke larutan yang memiliki konsentrasi lebih besar (terlarut) ini dinamakan osmosis.
Perpindahan tersebut menyebabkan perbedaan ketinggian permukaan antara larutan encer dan larutan pekat. Perbedaan ketinggian ini akan mengakibatkan adanya perbedaan tekanan pada kedua larutan tersebut. Perbedaan tekanan itu disebut tekanan osmosis. Jadi dapat dikatakan bahwa tekanan osmosis adalah tekanan yang diperlukan untuk menghentikan peristiwa osmosis. Makin tinggi konsentrasi larutan maka makin tinggi pula tekanan osmosis yang diperlukan untuk menhentikan peristiwa osmosis tersebut.
Menurut Van't Hoff, tekanan osmotik larutan dirumuskan :
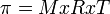
Keterangan :
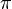 = tekanan osmotik
= tekanan osmotikM = molaritas larutan
R = tetapan gas ( 0,082 )
T = suhu mutlak



Tidak ada komentar:
Posting Komentar